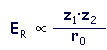
El enlace iónico es la unión que resulta de las fuerzas electrostáticas que se establecen entre iones de distinto signo (cationes y aniones). En los compuestos iónicos, los iones acaban formando redes cristalinas neutras y con el máximo empaquetamiento posible.
Las fórmulas de los compuestos iónicos son empíricas: representan la proporción de iones en la red. Por ejemplo la fórmula Al(NO3)3 representa que hay triple número de aniones nitrato que de cationes Al3+. Por tanto, hay que distinguir cuándo el subíndice representa un número concreto y cuándo sólo la proporción. En esta fórmula hay dos números con significados completamente distintos: el 3 del NO3- representa el número exacto de átomos de oxígeno en cada anión, pero el 3 que acompaña al nitrato no significa tres sino triple. No tiene sentido decir que en el nitrato de aluminio hay tres aniones nitrato, ya que por muy pequeña cantidad que cojamos siempre habrá números enormes de iones, pero siempre triple de aniones que de cationes.
En la nomenclatura de los compuestos iónicos binarios (por ejemplo: FeCl2, Ag2O, ZnBr2) se suele utilizar Stock: cloruro de hierro (II), óxido de plata y bromuro de zinc. Recuerda no escribir el estado de oxidación en números romanos en aquellos metales que sólo tienen un estado de oxidación.
Conceptos importantes:
- Electrovalencia: nº de electrones perdidos o ganados por un átomo que ha pasado a formar un ion monoatómico (representada por z , no confundir con Z = nº atómico).
- Índice de coordinación: nº de iones de un signo que rodean a otro de signo contrario a la mínima distancia.
- Energía reticular: energía necesaria para romper los enlaces iónicos de 1 mol de compuesto. También se define como la energía que se desprende cuando los iones necesarios forman los enlaces iónicos correspondientes y generan 1 mol de compuesto. Para calcular este valor (que es el mismo en las dos definiciones pero en un caso se considera positivo (energía necesaria) y en el otro negativo (energía desprendida) se puede utilizar el ciclo de Born-Haber (conjunto de procesos implicados en la formación de un compuesto iónico a partir de sus elementos en estado estándar) o la ecuación de Born y Landé que aparece a continuación en forma abreviada (∝ representa directamente proporcional)
|
|
|
|
|
|
r0 = distancia interiónica ≈ rcatión + ranión z1 y z2 = electrovalencias de los iones |